不凍タンパク質(AFP)の構造機能解析 津田 栄 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
updated on: 10-OCT-2023 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
不凍タンパク質(Antifreeze Protein: AFP、不凍糖タンパク質AFGPを含む)は 不凍機能(熱ヒステリシス活性)と細胞保護機能を併せ持つ非常に希有な物質です [1, 2, 3]。AFPは1969年から1984年にかけて南極海と北極海周辺に生息する魚類から相次いで発見されました [4, 5, 6, 7]。この為、AFPはかつては極地生物に固有の物質と考えられていました。津田らは2000年頃にAFPの探索を開始し、国内の様々な動植物がAFPをもつことをこれまで明らかにして来ました。日本人が普段食べているカレイ、ワカサギ、タラ等の切り身は豊富にAFPを含んでいます。北極海まで船を出さなくても、四方を海に囲まれた日本では容易にAFPを取得することが出来るわけです。日本産AFPの高純度試料の作製も可能になりました。オオクワガタやアカアシクワガタ等の昆虫がもつ高活性型AFPや菌類由来のAFPも次世代の省エネ技術をつくる大きな可能性を秘めています [8, 9, 10, 11]。組成や構造の違いに依らず、全てのAFPが不凍機能と細胞保護機能をもっています。AFPをもつ生物の例を以下に示します。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
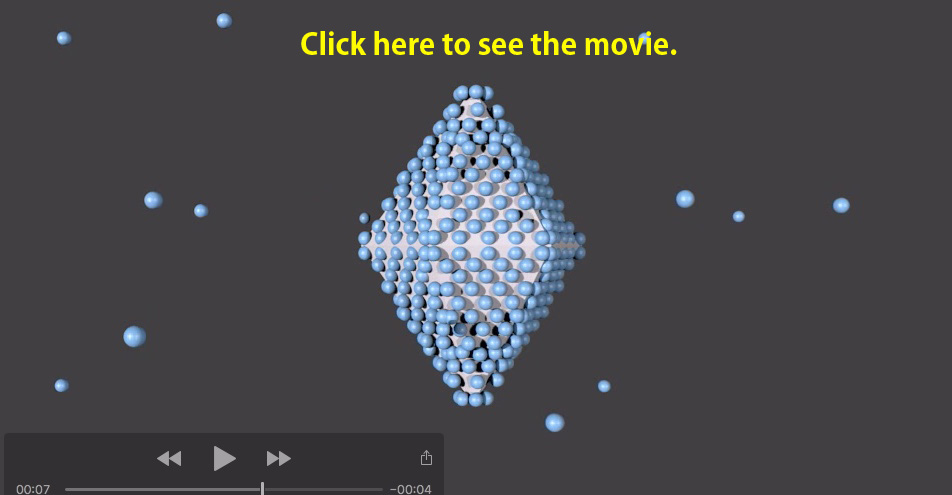
<AFPはどのように氷に結合するか (1)> AFPは凍結時に発生する個々の氷核に強く特異的に結合することで水の凍結を妨げる機能(不凍機能)を発揮します。下の動画はAFPが氷核に結合する様子を表したものです。はじめ氷核は円盤~楕円の様な形状をしており、その内部は鉛筆型の六角柱様に配列した水分子から出来ています。魚類AFPが純水中に50〜500μg/ml以上の濃度で存在しているとき、AFPがこの六角柱様の水分子の6つの側面に結合する結果として、氷核はご覧のような六方両錐型に変形します。Bipyramidal が六方両錐型を表す英語であることから、このような氷結晶は”バイピラミダル氷結晶(bipyramidal ice crystal)”と呼ばれています。なお、AFPの中には6つの側面に加えて2つの基底面にも結合する種類があり、そのようなAFPが結合すると氷核はバイピラミダルではなくレモン型に変形します。AFPを表面にまとった氷核は温度を多少降下させても変化しません。しかし温度を降下し続けるとAFPに十分に守られていない部位から爆発的に氷結晶成長が起こります(bursting ice growth)。バイピラミダル氷結晶の場合には上下の突端部位から成長が起こります。氷核が変化しない(融解も成長もしない)温度範囲のことを熱ヒステリシスと呼びます。すなわち熱ヒステリシスは、AFPが氷結晶の成長を止める強さを表します。*下のイラストをクリックすると動画が表示されます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
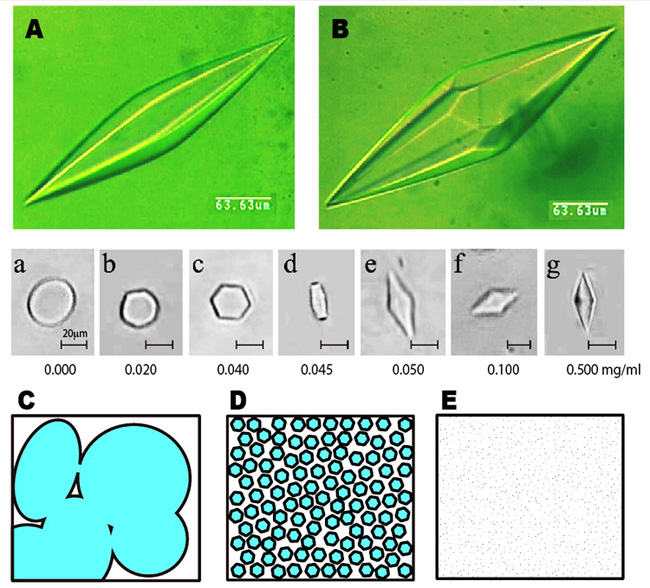
<AFPはどのように氷に結合するか (2)> AFPの水溶液を凍らせたときに出来る氷結晶の形状は、冷却ステージを備えた顕微鏡を用いれば簡単に撮影することが出来ます。図Aと図Bは、種類の異なる魚類AFPがそれぞれ結合したときに出来るバイピラミダル氷結晶の画像です。ご覧のように僅かに氷結晶形状が異なっており、それぞれ六方両錘体(hexagonal bipyramid)および六方偏四角面体(hexagonal trapezohedron)と呼ばれています。AFP中のたった1つのアミノ酸残基の置換が氷結晶形状に変化を与えることも知られています。中段のa〜gは、AFPの濃度に応じて氷核の形状がどのように変化するかを調べた結果です(試料:魚類I型AFP)。この様に、50μg/mlよりも低いAFP濃度ではバイピラミダル氷結晶ができないことが分かります。私達はこのAFP濃度のしきい値をCISC(Critical Ice Shaping Concentration)と呼んでいます。氷結晶の形状やCISCの値は塩、糖、グリセロール等によって変化します。ここで、通常の氷は、水が凍結する瞬間に発生する無数の氷核(中段のa)が成長と融合を繰り返して出来る多結晶氷です(図C)。魚類AFPは個々の氷核をb〜gの様に変化させて互いに結びつかせないように働きます。その結果、AFP水溶液の凍結物は微細氷結晶の集合状態に変化します(図E)。この様に微細氷結晶で埋め尽くすように凍結することで、食品、細胞、高分子ゲル等が被る凍結ダメージは大幅に軽減されます。この原理は、究極的には生物の凍結保存技術を可能にするかも知れません。こうした応用技術を考える際には、AFPの安全性を詳しく調べることが必要です。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
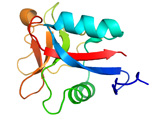
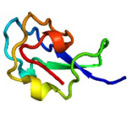
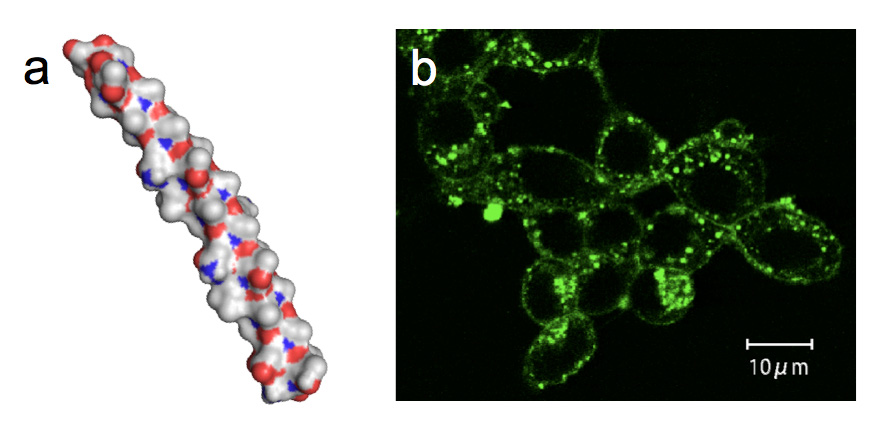
<AFPの細胞膜保護機能> カリフォルニア大学のルビンスキー教授らは、約4℃の非凍結温度域において魚類由来のAFPが細胞保護機能を発揮することを1990年に報告しました。それ以降、魚類AFPを用いて精子、卵子、臓器などを凍結寸前の温度まで冷却して保存する技術(チルド技術)が米国を中心に検討されてきました。しかし、AFPの量不足の問題等が解決できなかった為にこの技術は未完成のまま現在に至っています。私達は、糖尿病の治療に役立つとされるインスリン生産細胞(膵島細胞)を種々の魚類AFPを溶解した細胞保存液(ユーロコリンズ液)の中に浸し、+4℃下で同細胞の生存率が保存時間と共にどのように変化するかを調べました。その結果、120時間(5日間)のチルド保存後であっても約60%の膵島細胞が生きていることが明らかになりました。AFPを含まない液を用いた場合には、ほぼ全ての細胞が2日以内に死滅しました。保存後の膵島細胞はインスリン生産能力を保持していました。最も良好な性能を発揮した細胞保存液はトウガレイ由来のAFP(下図a、予測構造モデル)を含むものでした(参考:PLoS ONE 8 (9), e73643 (2013))。このAFPが膵島細胞の表面付近に集積している様子が共焦点レーザー顕微鏡により観察されたことから(下図b)、AFPの細胞保護機能は脂質二重膜に対する結合によってもたらされると推察されました。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
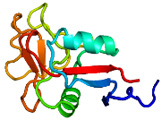
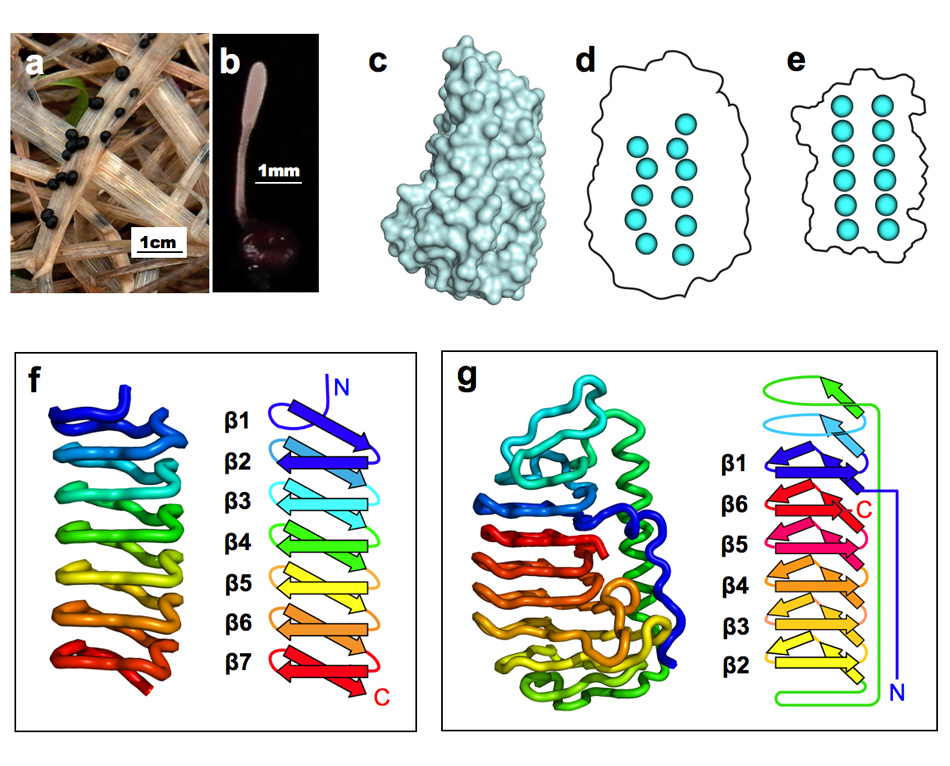
<担子菌類(きのこ類)が分泌するAFP> 私達が食べているシイタケ、エノキ、ブナシメジ、エリンギ、ナメコなどもAFPを生産しています。私達はこれら担子菌類(きのこ類)が生産するAFPの分子構造解析に世界で初めて成功しました(Proc. Natl. Acad. Sci., (2012),109 (24), 9360-9365.)。研究対象にしたのは北海道の芝生・牧草地帯であれば何処にでも生息している"チフラ・イシカリエンシス(Typhula ishikariensis)"という担子菌で(Tisと略、下写真a,b)、1930年頃に北海道石狩平野から発見された事がその学名の由来です。私達はこの菌がAFPを有することを2003年に報告し、更に約10年の歳月を要して今回の分子構造解明に至りました。下図のcが今回明らかになったTisが生産するAFP(TisAFPと略)の3次元分子構造です。松ぼっくりの一部表面がカットされたような独特の構造をしており、そのカット面が氷結晶に結合する部位です。TisAFPの最大の特徴は、この面に固く結びついている水分子(結合水)が不規則に配置している点です(下図d)。昆虫AFPの氷結晶結合面の結合水(下図e)に見られるような規則性がありません。これらの結合水は、AFPが氷と接した瞬間に氷の一部となることにより、AFPと氷を結合させる"錨 (いかり)"の役割を果たすと考えられています。TisAFPの結合水が不規則配置になってしまう理由はそのペプチド骨格から明らかになりました。昆虫AFPのペプチド骨格とその模式図を下図fに、TisAFPのそれらをgに示します。ご覧のように昆虫AFPのペプチド骨格はアミド基末端(N末端)から規則的に巻かれる"ベータ(β)らせん構造"によって順序良く構築されています。一方TisAFPでは、らせん中央付近にいきなりN末端側のβ1がやって来て、β1から遠く離れた位置からβ2~6が積み上がり、最後にC末端のβ6とβ1が隣接することで全体構造が作られます。この"ムリのある"らせん構造が分子骨格になっているために結合水の配置も乱れてしまうのだと考えられます。このような風変わりなβ構造は菌類AFP以外に報告例がありません(2012年7月時点)。私達は、恐らく膨大な種類の菌類AFPが、TisAFPと良く似た構造的特徴(下図g)を有すると考えています。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| a,b: 担子菌チフラ・イシカリエンシス(Tis)の菌核及び子実体、c: TisAFPの立体構造、d: TisAFPの分子表面の結合水(一部)、e: 昆虫AFPの分子表面の結合水、f: 昆虫AFPのペプチド主鎖構造とその模式図、g: TisAFPのペプチド主鎖構造とその模式図. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
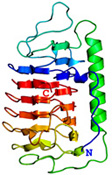
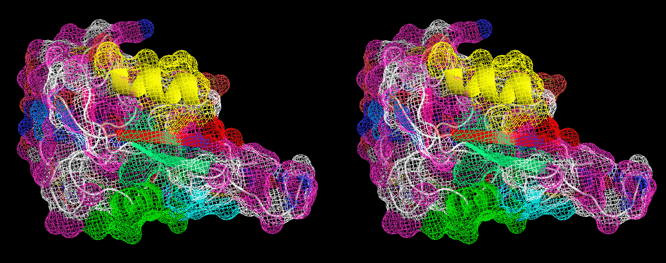
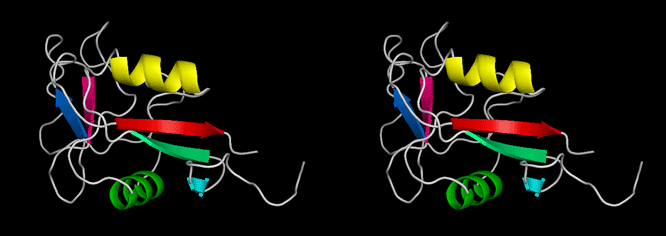
<Ca2+非依存型II型AFPのX線構造> 下の図は、私達がX線回折法を用いて明らかにしたCa2+非依存型AFPIIの3次元構造ステレオ表示図です。魚類AFPはアミノ酸組成(立体構造)の異なる4タイプ(AFPI~IV)に分類されます。このうちのAFPIとIIIのX線構造は1980年代に解かれましたが、AFPIIの構造は2000年代になっても不明のままでした。AFPIIはニシン等が有するCa2+依存型とケムシカジカ等が有するCa2+非依存型の2種類に細分類され(相同性=約42%)、両者がどのように異なるのかも長年に渡る非常に大きな謎でした。2007年、ニシン由来Ca2+依存型AFPIIのX線構造がHewのグループによって解かれ(PLoS ONE, 2007, 2(6), e548)同AFPがCa2+イオンを直接介して氷結晶と結合することが示されました。私達は2002年に北海道東部沿岸で捕獲されるシチロウウオがCa2+非依存型AFPIIを有することを見出し、2008年に同AFPIIのX線構造を解くことに世界で初めて成功しました(J.Mol.Biol. (2008), 382 (3), 734-746.)。その結果、同AFPはCa2+依存型AFPIIとはまったく異なる部位でCa2+イオンを介さずに氷結晶と結合することが明らかになりました。なお、北海道室蘭市にある 室蘭水族館 において、生きているシチロウウオを見ることができます(2008.7)。*右目で右の図を、左目で左の図を見ると分子が立体的に見えます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
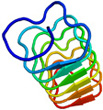
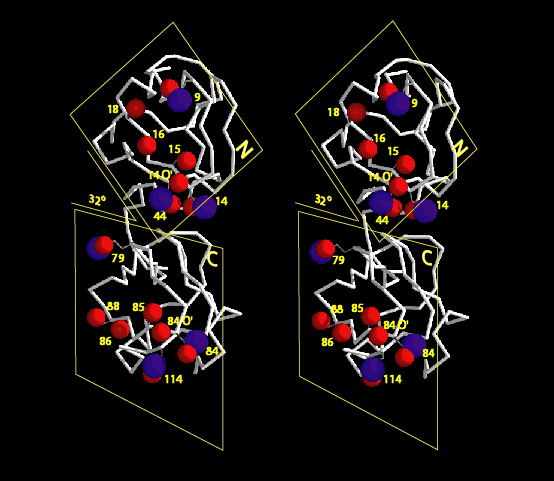
<2量体型AFPの分子構造解析> 下の図は、私達が13C/15N異種核多次元核磁気共鳴(NMR)法により決定した高機能二量体型AFP(RD3と略)の三次元構造ステレオ表示図です。RD3は、二つのIII型AFP(AFPIII)が9残基の連結部で結ばれた特別な構造を形成していることが分かりました。各々のドメインの表面には、氷結晶のプリズム面の酸素原子の位置にマッチするように複数の極性アミノ酸残基が配置していることも明らかになりました。これらの残基は平面内にあり、プレッツェル構造というらせん状構造に支えられて出来ています。これら2つの氷結晶結合平面は約32度の角度でかたむいており、Cドメインの面はNドメインの面に比べて約3.5オングストローム前方にあることも分かりました(参考:Biochemistry (2008), 47 (22), 5935-5941.; Biophys. J. (2007), 92, 541-546.; J.Biol.Chem. (2003), 278 (34), 32307-32312.; J. Biol. Chem. (2001), 276 (2),1304-1310.)。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 本ページに掲載の文章・画像の無断転用を禁じます。No reproduction or republication is allowed without a permission from Tsuda. |